
Los proyectos de investigación clínica son esenciales para poder descubrir nuevas formas de tratar ciertas condiciones oculares y mejorar los tratamientos actuales, poniendo el foco en la seguridad, la salud y la calidad de vida del/la paciente. Sin embargo, la investigación puede parecer inaccesible para personas que no forman parte de la comunidad académica o no disponen de conocimientos específicos de oftalmología.
Es por eso que en nuestra web tenemos, por un lado, un listado actualizado de los proyectos de investigación que estamos llevando a cabo en estos momentos. Y, a continuación, explicamos en qué consisten los ensayos clínicos, qué tipos se pueden realizar y de qué fases constan. De este modo, cualquier paciente que lo desee, puede consultar los proyectos actuales, ver si hay alguno del que puede beneficiarse o incluso participar de forma voluntaria.
Se trata de un tipo de estudio de investigación médica que pretende determinar si un tratamiento es seguro y eficaz en personas. Además de este objetivo principal (también llamado endpoint primario), los ensayos clínicos también pretenden aportar más información sobre el tratamiento analizado (endpoint secundario).
Este tipo de proyecto se inicia a partir de hipótesis de estudios in vitro, en animales, o estudios observacionales, en los que se encuentra evidencia parcial o razones para creer que el tratamiento estudiado puede presentar beneficios para cierto grupo de pacientes.
Cada ensayo clínico puede ser de distintos tipos o fases y tiene una duración variable (desde el inicio a la conclusión del estudio pueden pasar entre 7 y más de 20 años).
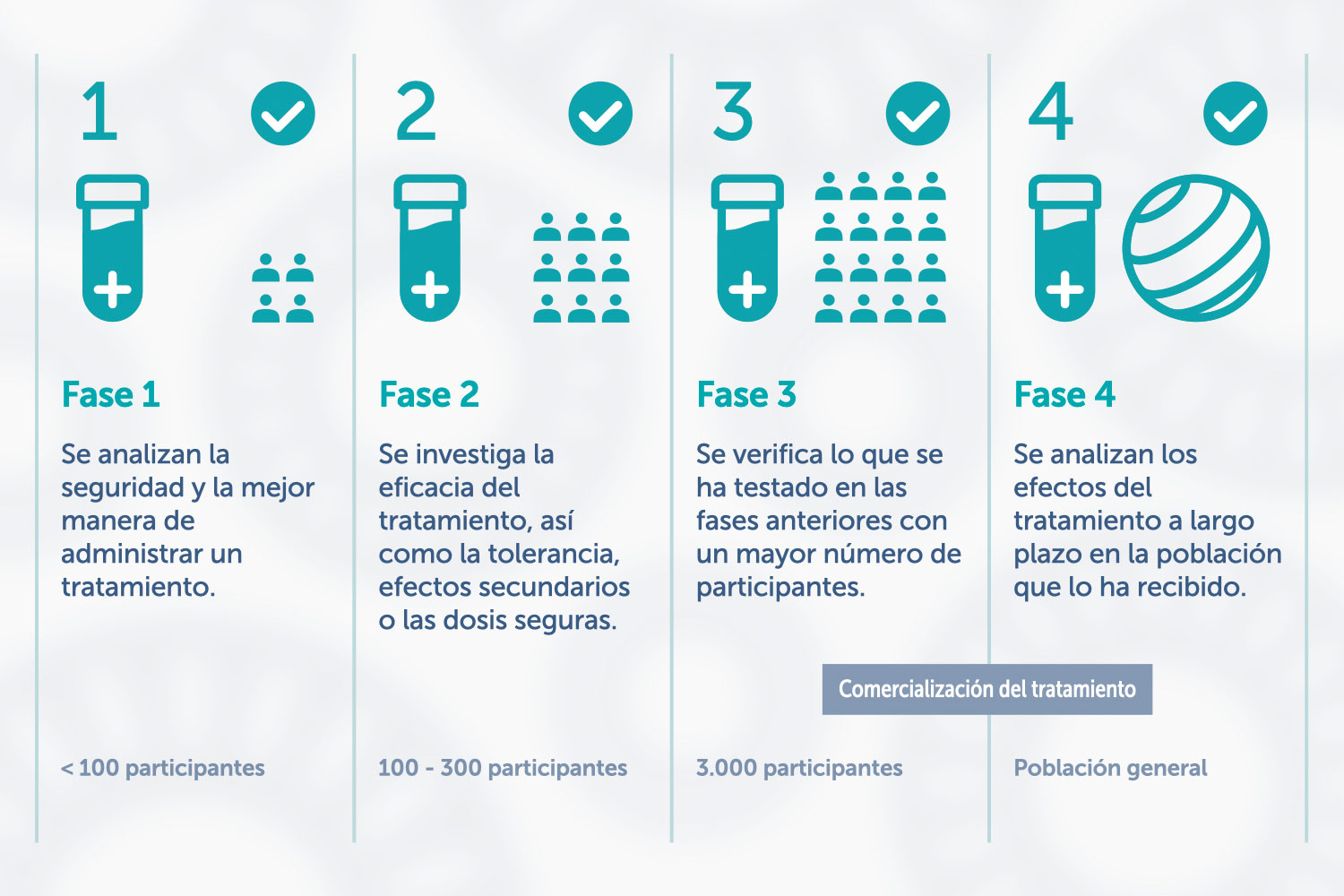
Un ensayo clínico puede constar de las siguientes fases:
Hay muchos tipos de ensayos clínicos, que pueden ser de diferentes tipos en función de múltiples factores.

Foto de Kaboompics.com en Pexels.

Escríbenos o pide hora para una consulta con nuestro equipo médico.